재료상변태 [3] 열역학 제 0법칙/ 1법칙/ 2법칙/ 3법칙
재료상변태 [2] Gibbs Free Energy
상변태Thermodynamics자발성/ stable/ 구동력의 크기 (gibbs free Energy)Kinetics얼마나 '빠르게' 일어나는가? 1. Gibbs Free Energy△Ga: 열처리(Annealing)으로 recrystallization 이때, △g가 클수록/ T가 작을수록 Energ
mayunchem.tistory.com
1. 열역학 제 0법칙 - 열적 평형 법칙
내용)
만약 A와 B가 열평형을 이루고, B와 C가 열평형을 이룬다면 A와 C도 열평형을 이룬다

의미)
- 온도의 개념을 정의하는 법칙이다.
2. 열역학 제 1법칙 - 에너지 보존 법칙
내용)
고립된 계( isolated System )에서 에너지는 생성되거나 소멸되지 않고, 형태가 변한다. 즉, 계의 내부 에너지 변화( ΔU )는 계로 들어오거나 나가는 열(Q)과 일(W)의 총합이다.
ΔU = Q + W

의미)
- 에너지는 보존되며, 한 형태에서 다른 형태로 변환될 수 있다.
- 열에너지를 일(Work)로 변환이 가능하다.
3. 열역학 제 2법칙 - 엔트로피 증가 법칙
내용)
자연계에서 모든 자발적인 과정은 엔트로피가 증가하는 방향으로 진행된다.
혹은, Isolated System에서 Spontaneous 반응이 일어날 때 ΔS는 증가한다.
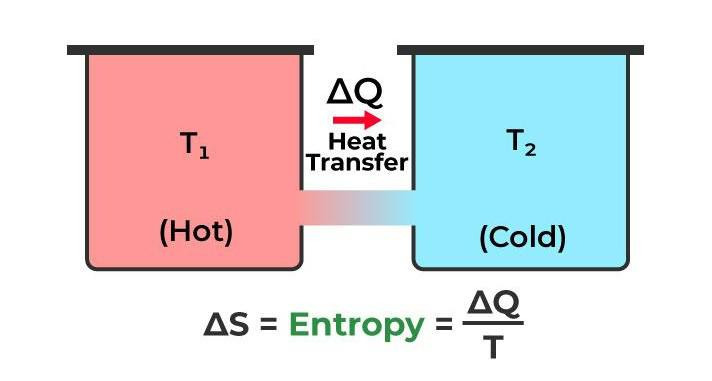

이 식의 의미는 온도가 높은 상태에서는 동일한 열량이 가해져도 엔트로피 변화가 적고, 온도가 낮을 수록 엔트로피 변화가 크다는 뜻이다.


i) 가역과정: ΔS_universe=0
- 가역과정에서는 우주의 총 엔트로피 변화가 0이다
ii) 비과역과정: ΔSuniverse >0
- 실제 자연에서는 엔트로피가 증가하는 방향으로 진행된다.
iii) 불가능: Δ
대표적인 형태)
1. 클라우지우스의 표현


cf. ∮S는 Rev와 Irr 모두 0이다. 왜냐하면 State function이기 때문이다.
- 열은 저온에서 고온으로 자연적으로 이동하지 않는다.
- 만일 냉장고처럼 열을 저온에서 고온으로 이동시키기 위해서는 외부에서 에너지를 공급해야한다.
2. 캘빈- 플랑크 표현
- 열기관이 단일 열원에서 일을 받아 100% 일을 할 수는 없다. 즉, 일부 에너지는 반드시 주변으로 방출되어야한다.

고온 열원의 온도가 높을 수록, 저온 열온의 온도가 낮을 수록 효율이 증가한다.

3. 엔트로피 증가 원리
- 고립된 계에서는 엔트로피가 감소하지 않고 증가하거나 일정하게 유지된다.
즉, (고립계에서 엔트로피 변화는 0 이상)
의미)
- 자연현상은 되돌릴 수 없는(비가역 과정)으로 진행됨
- 이상적인 열기관(100% 효율)은 존재하지 않는다.
4. 열역학 제 3법칙 - 절대영도와 엔트로피
내용)
절대온도(0K)에서는 완전히 결정된 상태에 도달하며, 이때 계의 엔트로피는 0에 수렴한다. 단 이때 결정은 perfect crystal이다.
Perfect Crystal이 아니면 Mixing Entropy(S_conf)를 가지기 때문에 S가 0에 수렴하지 않는다.
(S는 S_thermal과 S_configurational로 나뉜다)

의미)
- 절대영도에서는 모든 원자의 운동이 멈춘다
- 하지만, 실제로 절대영도에 도달하는 것은 불가능하다(무한히 가까워질수는 있다)